|
元素 名称 |
|
元素符号 |
|
原子 序数 |
|
相对原子质量 (12C = 12.0000) |
|
||||
| 英文名称 |
|
|
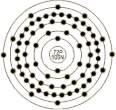
原 子 结 构 |
|
|
发 现 |
|
|
来 源 |
|
|
物 理 性 质 |
|
||||||||||||||||
|
化 学 性 质 |
|
|
地 质 数 据 |
|
|
生 物 数 据 |
|